Tekanan Osmotik pada Sifat Koligatif Larutan Non Elektrolit
Aliran suatu pelarut dari suatu larutan dengan konsentrasi lebih rendah ke larutan dengan konsentrasi tinggi melalui membran semipermiabel disebut osmosis. Besarnya tekanan yang dapat menghentikan peristiwa osmotik disebut tekanan osmotik. Salah satu dinding semipermiabel yang baik adalah tembaga (II) heksasianoferat (II).
Proses terjadinya osmotik diilustrasikan menggunakan gambar 3. Pada kondisi awal kedua permukaan yang sama tinggi antara pelarut/larutan encer dengan lartan yang lebih pekat; sedangkan setelah osmotik tekanan osmotik sama dengan tekanan hidrostatik yang diberikan oleh kolom cairan sebelah kanan keadaan kesetimbangan. Pada dasarnya pengaruh yang sama terjadi jika pelarut murni digantikan dengan larutan yang lebih encer daripada larutan yang ada di sebelah kanan.
Pada wadah tersebut, kedua larutan dipisahkan dengan membran semipermiabel yang memungkinkan molekul pelarut melewatinya tetapi menghalangi lewatnya zat terlarut. Pada awalnya, permukaan air memiliki tinggi permukaan yang sama. Setelah beberapa saat, permukaan di bagian kanan mulai naik hingga mencapai kondisi kesetimbangan. Gerakan molekul pelarut murni melewati membran semipermiabel dari pelarut murni atau pelarut encer ke larutan yang lebih pekat disebut osmosis.
Hubungan tekanan osmosis dengan kemolaran larutan oleh Van’t Hoff dapat dirumuskan sebagai berikut
Konsentrasi dinyatakan dengan molaritas, karena pengukuran tekanan osmotik dilakukan pada suhu tetap. Tekanan osmotik pun berbanding lurus dengan konsentrasi larutan.Jika kedua larutan mempunyai konsentrasi yang sama maka tekanan osmotik pun akan sama akan disebut keadaan isotonik. Jika kedua larutan memiliki tekanan osmotik yang tidak sama, larutan yang lebih pekat disebut hipertonik dan larutan yang lebih encer disebut hipotonik.
Hemolisis, yaitu kadar sel darah merah yang terlindungi dari lingkungan eksternal oleh membran semipermiable. Sel darah merah diletakkan dalam larutan hipotonik, karena larutan hipotonik kurang pekat dibandingkan larutan di dalam sel, air bergerak ke dalam sel. Sel akan menggembung dan akhirnya pecah membebaskan hemoglobin dan molekul lain
Referensi
Chang, Raymond. 2006. General Chemistry, Fourth Edition. New York:The McGraw–Hill Companies.
Hartanto, A dan Ruminten. 2009. Kimia untuk SMA kelas XII. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Johari .J.M.C dan M. Rachmawati.2008. KIMIA SMA dan MA untuk kelas XII. Jakarta: Erlangga.
Pangajuanto, T dan Tri R. 2009. Kimia 3 untuk SMA/MA kelas XII. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Purba. Michael. 2002. KIMIA untuk SMA kelas XII. Jakarta: Erlangga.
Supardi, K.I dan Gatot L.2014. Kimia Dasar II. Semarang : UNNES.
Supriatna, M,. Yayu S.R,. dan Aritta M.,2016. Modul Guru Pembelajar Mata Pelajaran Kimia Sekolah Menengah Atas (SMA). Jakarta: Direktorat Jenderal Guru dan Tenaga Kependidikan.
Utami, B., Agung N.C.S., Lina M., Sri Y., dan Bakti M. 2009. Kimia untuk SMA/MA kelas XII Program Ilmu Alam. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
 |
| Gambar 3. Tekanan osmotik. Sumber: Kortz dan Purcell |
Pada wadah tersebut, kedua larutan dipisahkan dengan membran semipermiabel yang memungkinkan molekul pelarut melewatinya tetapi menghalangi lewatnya zat terlarut. Pada awalnya, permukaan air memiliki tinggi permukaan yang sama. Setelah beberapa saat, permukaan di bagian kanan mulai naik hingga mencapai kondisi kesetimbangan. Gerakan molekul pelarut murni melewati membran semipermiabel dari pelarut murni atau pelarut encer ke larutan yang lebih pekat disebut osmosis.
Hubungan tekanan osmosis dengan kemolaran larutan oleh Van’t Hoff dapat dirumuskan sebagai berikut
 |
| Rumus Hubungan tekanan osmosis dengan kemolaran larutan oleh Van’t Hoff |
Hemolisis, yaitu kadar sel darah merah yang terlindungi dari lingkungan eksternal oleh membran semipermiable. Sel darah merah diletakkan dalam larutan hipotonik, karena larutan hipotonik kurang pekat dibandingkan larutan di dalam sel, air bergerak ke dalam sel. Sel akan menggembung dan akhirnya pecah membebaskan hemoglobin dan molekul lain
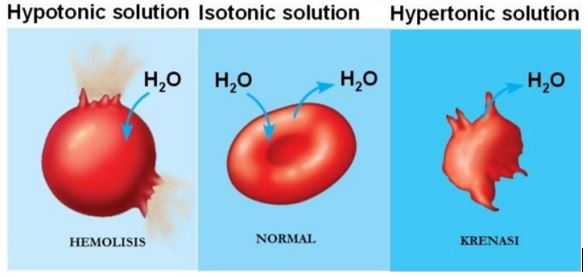 |
| Gambar 4. (a) larutan hipotonik (b) larutan isotonik (c) larutan hipertonik yang terjadi pada sel darah merah (Sumber: General chemistry) |
Chang, Raymond. 2006. General Chemistry, Fourth Edition. New York:The McGraw–Hill Companies.
Hartanto, A dan Ruminten. 2009. Kimia untuk SMA kelas XII. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Johari .J.M.C dan M. Rachmawati.2008. KIMIA SMA dan MA untuk kelas XII. Jakarta: Erlangga.
Pangajuanto, T dan Tri R. 2009. Kimia 3 untuk SMA/MA kelas XII. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Purba. Michael. 2002. KIMIA untuk SMA kelas XII. Jakarta: Erlangga.
Supardi, K.I dan Gatot L.2014. Kimia Dasar II. Semarang : UNNES.
Supriatna, M,. Yayu S.R,. dan Aritta M.,2016. Modul Guru Pembelajar Mata Pelajaran Kimia Sekolah Menengah Atas (SMA). Jakarta: Direktorat Jenderal Guru dan Tenaga Kependidikan.
Utami, B., Agung N.C.S., Lina M., Sri Y., dan Bakti M. 2009. Kimia untuk SMA/MA kelas XII Program Ilmu Alam. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Materi Terkait
- Rumus Molalitas dan Fraksi Mol
- Pengertian Sifat Koligatif Larutan
- Penurunan Tekanan Uap pada Sifat Koligatif Larutan Non Elektrolit
- Kenaikan Titik Didih (∆Tb) dan Penurunan Titik Beku (∆Tf) pada Sifat Koligatif Larutan Non Elektrolit
- Tekanan Osmotik pada Sifat Koligatif Larutan Non Elektrolit
- Sifat Koligatif Larutan Elektrolit
Posting Komentar untuk "Tekanan Osmotik pada Sifat Koligatif Larutan Non Elektrolit"