Kenaikan Titik Didih (∆Tb) dan Penurunan Titik Beku (∆Tf) pada Sifat Koligatif Larutan Non Elektrolit
Pada proses pendidihan terjadi karena panas meningkatkan gerakan atau energi kinetik, dari molekul yang menyebabkan cairan berada pada titik di mana cairan itu menguap. Titik didih cairan berhubungan dengan tekanan uap.
Jika sebuah larutan mempunyai tekanan uap yang tinggi pada suhu tertentu, maka molekul molekul yang berada dalam larutan tersebut mudah untuk melepaskan diri dari permukaan larutan menuju fasa uap jika mempunyai tekanan uap yang rendah, maka molekul-molekul dalam larutan tersebut tidak dapat dengan mudah melepaskan diri dari larutan menuju fasa uap. Jadi larutan dengan tekanan uap yang lebih tinggi pada suhu tertentu akan memiliki titik didih yang lebih rendah.
Cairan akan mendidih ketika tekanan uapnya menjadi sama dengan tekanan udara luar. Titik didih cairan pada tekanan udara 760 mmHg disebut titik didih standar atau titik didih normal. Jadi yang dimaksud dengan titik didih adalah suhu pada saat tekanan uap jenuh cairan itu sama dengan tekanan udara luar (tekanan pada permukaan cairan). Tekanan uap larutan lebih rendah dari tekanan uap pelarutnya disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarut sehingga laju penguapan berkurang.
Pada diagram 2. terlihat kurva putus-putus untuk larutan dan kurva biasa untuk pelarut murni. Diagram juga memperlihatkan titik didih larutan lebih tinggi dibandingkan titik didih air dan titik beku larutan lebih rendah dibandingkan titik beku air. Titik bertemunya ketiga garis kurva biasa disebut dengan titik Triple yang menyatakan keseimbangan ketiga fasa, yaitu padat, cair dan gas.
Selain itu, dapat terlihat bahwa pada suhu berapapun tekanan uap larutan lebih rendah daripada tekanan uap pelarut murninya. Sehingga mengakibatkan kurva larutan (putus-putus) memotong garis horisontal yang bertanda P=1 atm pada suhu yang lebih tinggi daripada titik didih normal pelarut murni. Analisis dari gambar 2. menunjukkan bahwa titik didih larutan lebih tinggi daripada titik didih pelarut murninya. Selisih antara titik didih suatu larutan dengan titik didih pelarut murni disebut kenaikan titik didih larutan (∆Tb).
Pada diagram fasa, gambar 2. menunjukan bahwa penurunan tekanan uap larutan bergeser kurva padatan – cairan ke arah kiri. Akibatnya, garis ini memotong garis horisontal pada suhu yang lebih rendah daripada titik beku air. Hal ini menyebabkan penurunan titik beku larutan lebih rendah dibandingkan dengan penurunan titik beku pelarut murni. Selisih temperatur titik beku larutan dengan titik beku pelarut murni disebut penurunan titik beku larutan (∆Tf)
Menurut Hukum Backman dan Raoult bahwa penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut di dalamnya. Hukum tersebut dapat dirumuskan sebagai berikut
Kb adalah konstanta kenaikan titik didih molal dan m adalah molalitas larutan. Satuan Kb adalah oC/m. Perlu diketahui bahwa sistem larutan suhunya tidak dijaga tetap sehingga kita tidak dapat menyatakan satuan konsentrasi bukan dalam molaritas, karena molaritas berubah jika suhu berubah atau terkait dengan volume jadi jika dipanaskan/didinginkan volume akan berubah. Untuk menghindarinya digunakan satuan molal. Harga Kb dan Kf untuk beberapa pelarut dicantumkan pada Tabel 1. Dengan data tetapan titik didih dan titik beku molal dapat ditentukan titik didih suatu larutan, konsentrasi larutan, dan massa molekul relatif.
Ketika suatu larutan dibekukan, yang membeku adalah pelarutnya. Contohnya es yang terbentuk di permukaan laut pada musim dingin adalah air murni (tawar). Zat terlarut akan memasuki pelarut yang belum membeku dan dengan demikian larutan semakin pekat.semakin pekat larutansemakin rendah titik bekunya. Sehingga larutaan tidak membeku pada suhu yang tetap. Yang dimaksud titik beku adalah suhu pada saat larutan mulai membeku.
Referensi
Chang, Raymond. 2006. General Chemistry, Fourth Edition. New York:The McGraw–Hill Companies.
Hartanto, A dan Ruminten. 2009. Kimia untuk SMA kelas XII. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Johari .J.M.C dan M. Rachmawati.2008. KIMIA SMA dan MA untuk kelas XII. Jakarta: Erlangga.
Pangajuanto, T dan Tri R. 2009. Kimia 3 untuk SMA/MA kelas XII. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Purba. Michael. 2002. KIMIA untuk SMA kelas XII. Jakarta: Erlangga.
Supardi, K.I dan Gatot L.2014. Kimia Dasar II. Semarang : UNNES.
Supriatna, M,. Yayu S.R,. dan Aritta M.,2016. Modul Guru Pembelajar Mata Pelajaran Kimia Sekolah Menengah Atas (SMA). Jakarta: Direktorat Jenderal Guru dan Tenaga Kependidikan.
Utami, B., Agung N.C.S., Lina M., Sri Y., dan Bakti M. 2009. Kimia untuk SMA/MA kelas XII Program Ilmu Alam. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Jika sebuah larutan mempunyai tekanan uap yang tinggi pada suhu tertentu, maka molekul molekul yang berada dalam larutan tersebut mudah untuk melepaskan diri dari permukaan larutan menuju fasa uap jika mempunyai tekanan uap yang rendah, maka molekul-molekul dalam larutan tersebut tidak dapat dengan mudah melepaskan diri dari larutan menuju fasa uap. Jadi larutan dengan tekanan uap yang lebih tinggi pada suhu tertentu akan memiliki titik didih yang lebih rendah.
Cairan akan mendidih ketika tekanan uapnya menjadi sama dengan tekanan udara luar. Titik didih cairan pada tekanan udara 760 mmHg disebut titik didih standar atau titik didih normal. Jadi yang dimaksud dengan titik didih adalah suhu pada saat tekanan uap jenuh cairan itu sama dengan tekanan udara luar (tekanan pada permukaan cairan). Tekanan uap larutan lebih rendah dari tekanan uap pelarutnya disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarut sehingga laju penguapan berkurang.
 |
| Diagram fasa yang mengilustrasikan kenaikan titik didih dan penurunan titik beku larutan berair |
Selain itu, dapat terlihat bahwa pada suhu berapapun tekanan uap larutan lebih rendah daripada tekanan uap pelarut murninya. Sehingga mengakibatkan kurva larutan (putus-putus) memotong garis horisontal yang bertanda P=1 atm pada suhu yang lebih tinggi daripada titik didih normal pelarut murni. Analisis dari gambar 2. menunjukkan bahwa titik didih larutan lebih tinggi daripada titik didih pelarut murninya. Selisih antara titik didih suatu larutan dengan titik didih pelarut murni disebut kenaikan titik didih larutan (∆Tb).
 |
| Gambar 2. Rumus kenaikan titik didih larutan |
 |
| Rumus penurunan titik beku larutan |
 |
| rumus kenaikan titik didih larutan dan penurunan titik beku larutan |
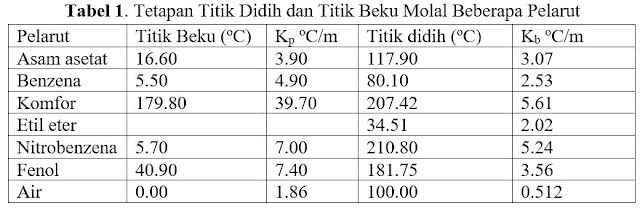 |
| Tetapan Titik Didih dan Titik Beku Molal Beberapa Pelarut |
Mengapa dapat terjadi penurunan titik beku larutan?
Pembekuan melibatkan transisi dari keadaan tidak teratur menjadi teratur sehingga energi harus diambil dari sistem. Larutan lebih tidak teratur dibandingkan pelarut, maka lebih banyak energi yang harus diambil darinya untuk menciptakan keteraturan dibandingkan dalam kasus pelarut murni. Jadi, larutan memiliki titik beku lebih rendah dibandingkan pelarut.Ketika suatu larutan dibekukan, yang membeku adalah pelarutnya. Contohnya es yang terbentuk di permukaan laut pada musim dingin adalah air murni (tawar). Zat terlarut akan memasuki pelarut yang belum membeku dan dengan demikian larutan semakin pekat.semakin pekat larutansemakin rendah titik bekunya. Sehingga larutaan tidak membeku pada suhu yang tetap. Yang dimaksud titik beku adalah suhu pada saat larutan mulai membeku.
Referensi
Chang, Raymond. 2006. General Chemistry, Fourth Edition. New York:The McGraw–Hill Companies.
Hartanto, A dan Ruminten. 2009. Kimia untuk SMA kelas XII. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Johari .J.M.C dan M. Rachmawati.2008. KIMIA SMA dan MA untuk kelas XII. Jakarta: Erlangga.
Pangajuanto, T dan Tri R. 2009. Kimia 3 untuk SMA/MA kelas XII. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Purba. Michael. 2002. KIMIA untuk SMA kelas XII. Jakarta: Erlangga.
Supardi, K.I dan Gatot L.2014. Kimia Dasar II. Semarang : UNNES.
Supriatna, M,. Yayu S.R,. dan Aritta M.,2016. Modul Guru Pembelajar Mata Pelajaran Kimia Sekolah Menengah Atas (SMA). Jakarta: Direktorat Jenderal Guru dan Tenaga Kependidikan.
Utami, B., Agung N.C.S., Lina M., Sri Y., dan Bakti M. 2009. Kimia untuk SMA/MA kelas XII Program Ilmu Alam. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Materi Terkait
- Rumus Molalitas dan Fraksi Mol
- Pengertian Sifat Koligatif Larutan
- Penurunan Tekanan Uap pada Sifat Koligatif Larutan Non Elektrolit
- Kenaikan Titik Didih (∆Tb) dan Penurunan Titik Beku (∆Tf) pada Sifat Koligatif Larutan Non Elektrolit
- Tekanan Osmotik pada Sifat Koligatif Larutan Non Elektrolit
- Sifat Koligatif Larutan Elektrolit

Posting Komentar untuk "Kenaikan Titik Didih (∆Tb) dan Penurunan Titik Beku (∆Tf) pada Sifat Koligatif Larutan Non Elektrolit"